*الفكرة الرئيسة : تحدد القوى بين الجزيئات-ومنها قوى التشتت، والقوى البين الثنائية القطبية ، والروابط الهيدروجينية-حالة الماء عند درجة معينة.
- قوى بين الجزيئات :
· تسمى قوى التجاذب التي تربط بين جسيمات المادة بروابط أيونية و تساهمية و فلزية بقوى الترابط الجزيئية ( intramolecular forces ) .
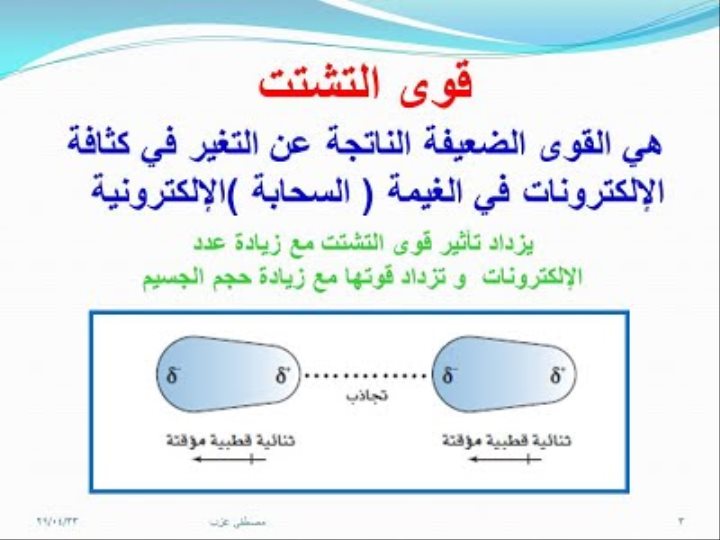
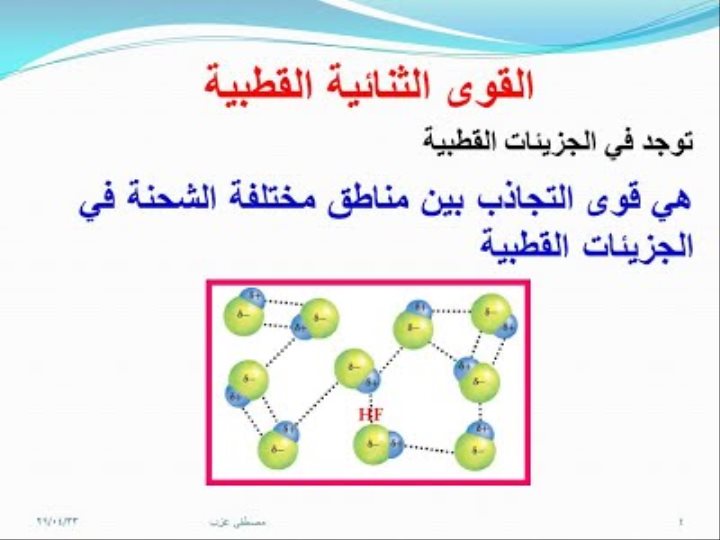
· يقصد الجزيئية الذرات والأيونات والجزيئات ، لا تمثل قوى الترابط الجزيئية كافة قوى التجاذب بين الجسيمات ، بل هناك قوى تجاذب اخرى تسمى القوى بين الجزيئات .
· قوى بينية تربط بين جسيمات متشابهة ، مثل تلك التي بين جزيئات الماء، او بين جسيمات مختلفة مثل ذرات الكربون في الجرافيت وجسيمات السليلوز في الورق .
· القوى بين الجزيئات كلها اضعف من قوى الترابط داخل الجزيئات .
قوى التجاذب بين الجزيئية - YouTube
https://www.youtube.com/watch?v=TF1S9hbFhkQ